Gli anticorpi, chiamati anche immunoglobuline (Ig), sono glicoproteine che si legano specificamente agli antigeni.
La preparazione anticorpale convenzionale viene prodotta immunizzando gli animali e raccogliendo l'antisiero.Pertanto, l'antisiero di solito contiene anticorpi contro altri antigeni non correlati e altri componenti proteici nel siero.Le molecole di antigeni generali contengono principalmente più epitopi diversi, quindi gli anticorpi convenzionali sono anche una miscela di anticorpi contro più epitopi diversi.Anche gli anticorpi sierici convenzionali diretti contro lo stesso epitopo sono ancora composti da anticorpi eterogenei prodotti da diversi cloni di cellule B.Pertanto, gli anticorpi sierici convenzionali sono anche chiamati anticorpi policlonali, o anticorpi policlonali in breve.
L'anticorpo monoclonale (anticorpo monoclonale) è un anticorpo altamente uniforme prodotto da un singolo clone di cellule B e diretto solo contro un epitopo specifico.Di solito è preparato dalla tecnologia dell'ibridoma: la tecnologia degli anticorpi dell'ibridoma si basa sulla tecnologia di fusione cellulare, combinando le cellule B con la capacità di secernere anticorpi specifici e cellule di mieloma con capacità di crescita infinita negli ibridomi delle cellule B.Questa cellula di ibridoma ha le caratteristiche di una cellula madre.Può proliferare indefinitamente e immortalmente in vitro come le cellule del mieloma e può sintetizzare e secernere anticorpi specifici come i linfociti splenici.Attraverso il clonaggio si può ottenere una linea monoclonale derivata da una singola cellula di ibridoma, cioè una linea cellulare di ibridoma.Gli anticorpi che produce sono anticorpi altamente omogenei contro lo stesso determinante antigenico, cioè anticorpi monoclonali.
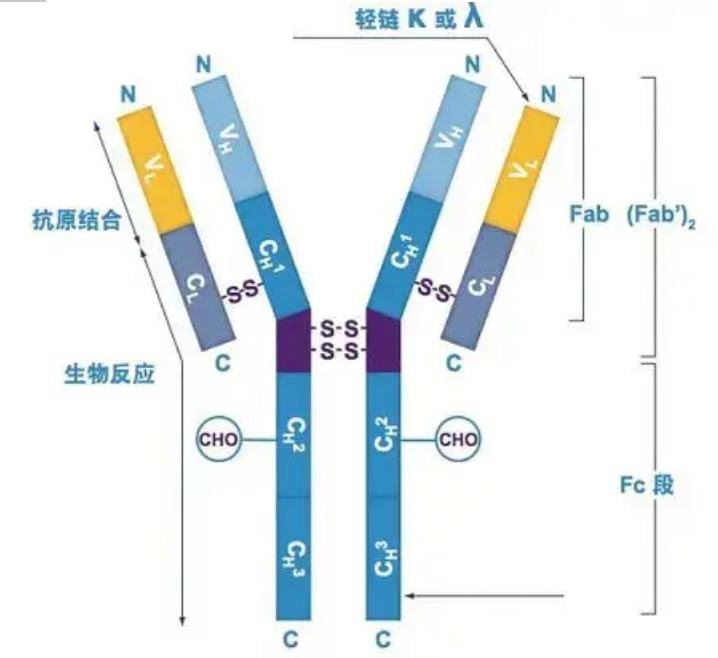
Gli anticorpi esistono come uno o più monomeri a forma di Y (cioè anticorpi monoclonali o anticorpi policlonali).Ogni monomero a forma di Y è composto da 4 catene polipeptidiche, incluse due catene pesanti identiche e due catene leggere identiche.La catena leggera e la catena pesante sono denominate in base al loro peso molecolare.La parte superiore della struttura a forma di Y è la regione variabile, che è il sito di legame dell'antigene.(Estratto da Detai Bio-Monoclonal Antibody Concept)
Struttura anticorpale
 Catena pesante
Catena pesante
Esistono cinque tipi di catene pesanti Ig dei mammiferi, denominate con le lettere greche α, δ, ε, γ e μ.Gli anticorpi corrispondenti sono chiamati IgA, IgD, IgE, IgG e IgM.Diverse catene pesanti differiscono per dimensioni e composizione.α e γ contengono circa 450 amminoacidi, mentre μ ed ε contengono circa 550 amminoacidi.
Ogni catena pesante ha due regioni: la regione costante e la regione variabile.Tutti gli anticorpi dello stesso tipo hanno la stessa regione costante, ma ci sono differenze tra anticorpi di tipi diversi.Le regioni costanti delle catene pesanti γ, α e δ sono composte da tre domini Ig in tandem, con una regione cerniera per aumentarne la flessibilità;le regioni costanti delle catene pesanti μ e ε sono composte da 4 domini Ig.La regione variabile della catena pesante dell'anticorpo prodotta da diverse cellule B è diversa, ma la regione variabile dell'anticorpo prodotto dalla stessa cellula B o clone cellulare è la stessa e la regione variabile di ciascuna catena pesante è lunga circa 110 amminoacidi., e formano un unico dominio Ig.
Catena leggera
Esistono solo due tipi di catene leggere nei mammiferi: tipo lambda e tipo kappa.Ogni catena leggera ha due domini collegati: una regione costante e una regione variabile.La lunghezza della catena leggera è di circa 211~217 amminoacidi.Le due catene leggere contenute in ciascun anticorpo sono sempre le stesse.Per i mammiferi, la catena leggera in ciascun anticorpo ha un solo tipo: kappa o lambda.In alcuni vertebrati inferiori, come i pesci cartilaginei (pesci cartilaginei) e i pesci ossei, si trovano anche altri tipi di catene leggere come il tipo iota (iota).
Segmenti Fab e Fc
Il segmento Fc può essere combinato direttamente con enzimi o coloranti fluorescenti per etichettare gli anticorpi.È la parte in cui l'anticorpo si rivetta sulla piastra durante il processo ELISA, ed è anche la parte in cui il secondo anticorpo viene riconosciuto e legato in immunoprecipitazione, immunoblotting e immunoistochimica.Gli anticorpi possono essere idrolizzati in due segmenti F(ab) e un segmento Fc da enzimi proteolitici come la papaina, oppure possono essere rotti dalla regione cerniera dalla pepsina e idrolizzati in un segmento F(ab)2 e un segmento Fc.I frammenti di anticorpi IgG sono talvolta molto utili.A causa della mancanza del segmento Fc, il segmento F(ab) non precipiterà con l'antigene, né sarà catturato dalle cellule immunitarie negli studi in vivo.A causa dei piccoli frammenti molecolari e della mancanza di funzione di reticolazione (a causa della mancanza del segmento Fc), il segmento Fab viene solitamente utilizzato per la radiomarcatura negli studi funzionali e il segmento Fc viene utilizzato principalmente come agente bloccante nella colorazione istochimica.
Regioni variabili e costanti
La regione variabile (regione V) si trova a 1/5 o 1/4 (contenente circa 118 residui amminoacidici) della catena H vicino all'N-terminale e 1/2 (contenente circa 108-111 residui amminoacidici) vicino all'N-terminale della catena L.Ogni regione V ha un anello peptidico formato da legami disolfuro intra-catena e ogni anello peptidico contiene circa 67-75 residui di amminoacidi.La composizione e la disposizione degli amminoacidi nella regione V determinano la specificità di legame dell'antigene dell'anticorpo.A causa dei tipi e della sequenza in continua evoluzione degli amminoacidi nella regione V, si possono formare molti tipi di anticorpi con diverse specificità dell'antigene di legame.Le regioni V della catena L e della catena H sono chiamate rispettivamente VL e VH.In VL e VH, la composizione e la sequenza degli amminoacidi di alcune regioni locali hanno un grado di variazione più elevato.Queste regioni sono chiamate regioni ipervariabili (HVR).La composizione amminoacidica e la disposizione delle parti non HVR nella regione V sono relativamente conservative, che è chiamata regione quadro.Ci sono tre regioni ipervariabili in VL, solitamente situate rispettivamente nei residui di amminoacidi da 24 a 34 e da 89 a 97.I tre HVR di VL e VH sono denominati rispettivamente HVR1, HVR2 e HVR3.La ricerca e l'analisi della diffrazione del cristallo di raggi X ha dimostrato che la regione ipervariabile è effettivamente il luogo in cui si lega l'antigene dell'anticorpo, quindi è chiamata regione determinante la complementarità (CDR).L'HVR1, HVR2 e HVR3 di VL e VH possono essere chiamati rispettivamente CDR1, CDR2 e CDR3.Generalmente, CDR3 ha un più alto grado di ipervariabilità.La regione ipervariabile è anche la posizione principale in cui esistono i determinanti idiotipici delle molecole di Ig.Nella maggior parte dei casi, la catena H svolge un ruolo più importante nel legame con l'antigene.
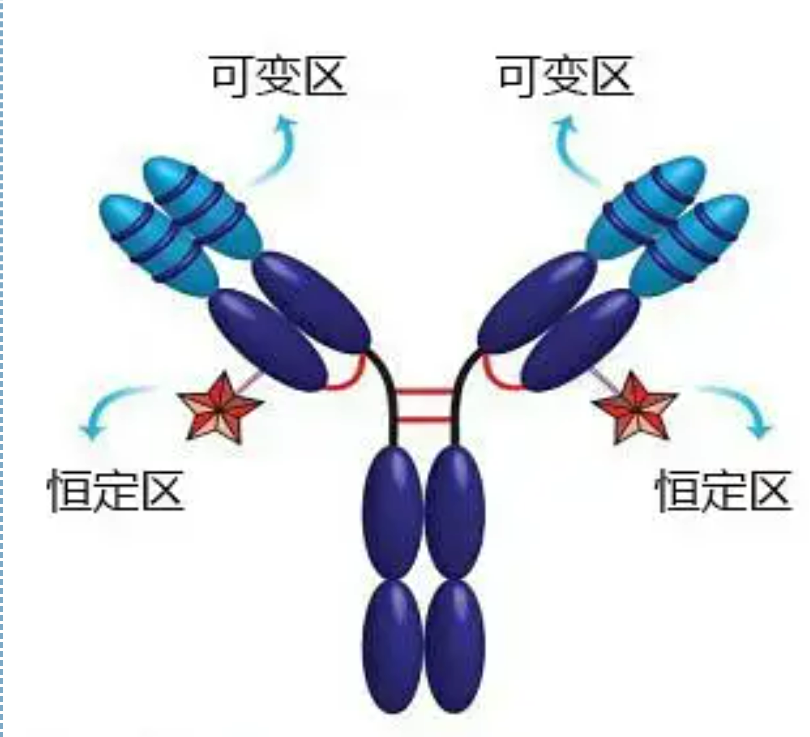 La regione costante (regione C)si trova a 3/4 o 4/5 (approssimativamente dall'amminoacido 119 al terminale C) della catena H vicino al terminale C e 1/2 (contiene circa 105 residui di amminoacidi) vicino al terminale C della catena L.Ogni regione funzionale della catena H contiene circa 110 residui amminoacidici e contiene un anello peptidico composto da 50-60 residui amminoacidici collegati da legami disolfuro.La composizione amminoacidica e la disposizione di questa regione sono relativamente costanti nella stessa catena di isotipo L di Ig animale e nella stessa catena di tipo H.Lo stesso, può solo legarsi specificamente all'antigene corrispondente, ma la struttura della sua regione C è la stessa, cioè ha la stessa antigenicità.L'anticorpo secondario IgG anti-umano di cavallo (o anticorpo) può essere combinato con i due Si verifica una combinazione di anticorpi (IgG) contro diverse esotossine.Questa è una base importante per la preparazione di anticorpi secondari e l'applicazione di fluoresceina, isotopi, enzimi e altri anticorpi marcati.
La regione costante (regione C)si trova a 3/4 o 4/5 (approssimativamente dall'amminoacido 119 al terminale C) della catena H vicino al terminale C e 1/2 (contiene circa 105 residui di amminoacidi) vicino al terminale C della catena L.Ogni regione funzionale della catena H contiene circa 110 residui amminoacidici e contiene un anello peptidico composto da 50-60 residui amminoacidici collegati da legami disolfuro.La composizione amminoacidica e la disposizione di questa regione sono relativamente costanti nella stessa catena di isotipo L di Ig animale e nella stessa catena di tipo H.Lo stesso, può solo legarsi specificamente all'antigene corrispondente, ma la struttura della sua regione C è la stessa, cioè ha la stessa antigenicità.L'anticorpo secondario IgG anti-umano di cavallo (o anticorpo) può essere combinato con i due Si verifica una combinazione di anticorpi (IgG) contro diverse esotossine.Questa è una base importante per la preparazione di anticorpi secondari e l'applicazione di fluoresceina, isotopi, enzimi e altri anticorpi marcati.
Prodotti correlati:
Kit Cell Direct RT-qPCR
Tempo di pubblicazione: 30 settembre 2021








