Negli esperimenti qPCR, anche il design dei primer è un collegamento molto importante.L'idoneità o meno dei primer è strettamente correlata al fatto che l'efficienza di amplificazione raggiunga lo standard, alla specificità dei prodotti amplificati e alla disponibilità dei risultati sperimentali.
Quindi, come migliorare la specificità del primer qPCR?Elevata efficienza di amplificazione?
Oggi ti porteremo a progettare insieme i primer qPCR e lasciare che il design dei primer qPCR diventi un'abilità di conoscenza efficiente negli esperimenti.
Quando si progettano i primer qPCR, di solito prestare attenzione ai seguenti punti: i primer dovrebbero essere progettati il più possibile tra gli introni, la lunghezza del prodotto dovrebbe essere 100-300 bp, il valore Tm dovrebbe essere il più vicino possibile a 60°C, e i primer a monte e a valle dovrebbero essere il più vicino possibile, e la fine del primer dovrebbe essere G o C, ecc. attendere.
1. Progettazione di primer che coprono gli introni
Quando si progettano i primer qPCR, la scelta di primer progettati attraverso gli introni può impedire l'amplificazione del modello gDNA e i prodotti sono tutti derivati dall'amplificazione del cDNA, eliminando così l'influenza della contaminazione del gDNA.
2. Lunghezza dell'innesco
La lunghezza del primer è generalmente compresa tra 18 e 30 nt e la lunghezza del prodotto di amplificazione deve essere controllata il più possibile tra 100 e 300 bp.
Se il primer è troppo corto, porterà a un'amplificazione non specifica e se è troppo lungo, formerà facilmente una struttura secondaria (come la struttura a forcina).Se il prodotto di amplificazione è troppo lungo, non è adatto per la reazione della polimerasi, che influirà sull'efficienza dell'amplificazione PCR.
3. Contenuto in GC e valore Tm
Il contenuto di GC dei primer deve essere controllato tra il 40% e il 60%.Se è troppo alto o troppo basso, non favorisce l'avvio della reazione.Il contenuto GC dei primer forward e reverse dovrebbe essere vicino allo stesso per ottenere lo stesso valore Tm e la stessa temperatura di ricottura.
Il valore Tm dovrebbe essere il più possibile compreso tra 55-65°C, generalmente intorno ai 60°C, e il valore Tm a monte ea valle dovrebbe essere il più vicino possibile, preferibilmente non superiore a 4°C.
4. Evitare di selezionare A all'estremità 3′ del primer
Quando l'estremità 3 'del primer non è corrispondente, ci sono grandi differenze nell'efficienza di sintesi delle diverse basi.Quando l'ultima base è A, può anche avviare la sintesi della catena anche in caso di mismatching, e quando l'ultima base è T When , l'efficienza dell'induzione del mismatch è notevolmente ridotta.Pertanto, cerca di evitare di scegliere A all'estremità 3′ del primer, ed è meglio scegliere T.
Se si tratta di un primer sonda, l'estremità 5′ della sonda non può essere G, perché anche quando una singola base G è collegata al gruppo reporter fluorescente FAM, G può anche estinguere il segnale fluorescente emesso dal gruppo FAM, risultando in risultati falsi negativi.Apparire.
5. Distribuzione di base
La distribuzione delle quattro basi nel primer è preferibilmente casuale, evitando più di 3 G o C consecutivi all'estremità 3′ e più di 3 consecutiviG o C sono facili da generare accoppiamenti nella regione della sequenza ricca di GC.
6. La regione di progettazione del primer dovrebbe evitare strutture secondarie complesse.
La struttura secondaria formata dal singolo filamento del prodotto di amplificazione influenzerà il buon andamento della PCR.Prevedendo in anticipo se esiste una struttura secondaria nella sequenza target, cerca di evitare questa regione nella progettazione dei primer.
7. I primer stessi e tra i primer dovrebbero cercare di evitare basi complementari consecutive.
Non può esserci una complementarità consecutiva di 4 basi tra il primer stesso e il primer.Il primer stesso non dovrebbe avere una sequenza complementare, altrimenti si piegherà per formare una struttura a forcina, che influirà sulla combinazione di ricottura del primer e dello stampo.
Le sequenze complementari non possono esistere tra i primer a monte ea valle.La complementarità tra i primer produrrà dimeri di primer, che ridurranno l'efficienza della PCR e influenzeranno anche l'accuratezza quantitativa.Se le strutture primer-dimero e forcina sono inevitabili, il valore △G non dovrebbe essere troppo alto (dovrebbe essere inferiore a 4,5 kcal/mol).
8. I primer amplificano il prodotto specifico target.
L'obiettivo finale del rilevamento qPCR è comprendere l'abbondanza del gene bersaglio.Se si verifica un'amplificazione non specifica, la quantificazione sarà imprecisa.Pertanto, dopo che i primer sono stati progettati, devono essere testati da BLAST e la specificità dei prodotti viene confrontata nel database delle sequenze.
Successivamente, prendiamo il gene umano GAS6 (Growth arrest specific 6) come esempio per progettare i primer qPCR.
01 gene di ricerca
Omo GAS6tramite NCBI.Qui, dovremmo prestare attenzione al confronto del nome del gene e della specie per assicurarci che siano coerenti.
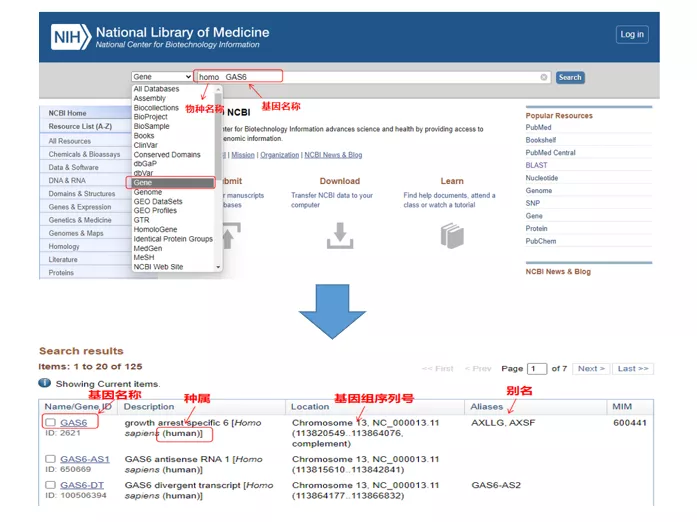 02 Trova la sequenza del gene
02 Trova la sequenza del gene
(1) Se la sequenza bersaglio è il DNA genomico, selezionare la prima, che è la sequenza del DNA genomico del gene.
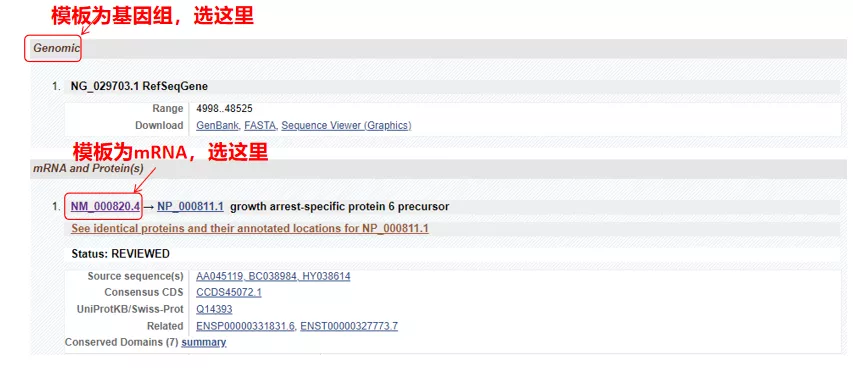 (2) Se la sequenza target è mRNA, selezionare la seconda.Dopo aver effettuato l'accesso, fare clic su "CDS" nella tabella sottostante.La sequenza di sfondo marrone è la sequenza codificante del gene.
(2) Se la sequenza target è mRNA, selezionare la seconda.Dopo aver effettuato l'accesso, fare clic su "CDS" nella tabella sottostante.La sequenza di sfondo marrone è la sequenza codificante del gene.
 03 Primer di design
03 Primer di design
Accedi all'interfaccia Primer-BLAST
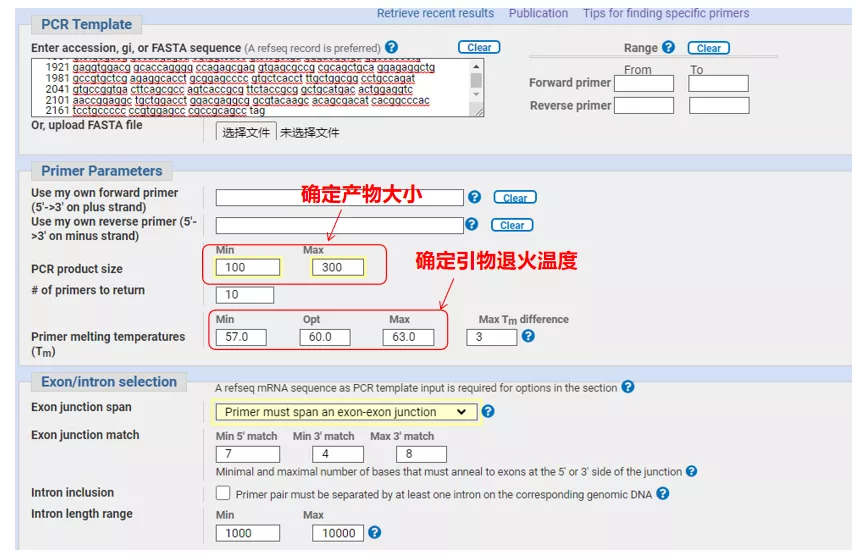
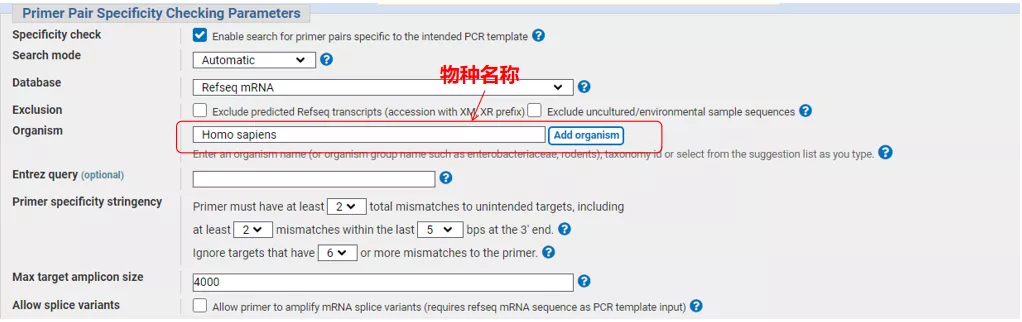
 Immettere il numero di sequenza del gene o la sequenza in formato Fasta in alto a sinistra e compilare i relativi parametri.
Immettere il numero di sequenza del gene o la sequenza in formato Fasta in alto a sinistra e compilare i relativi parametri.
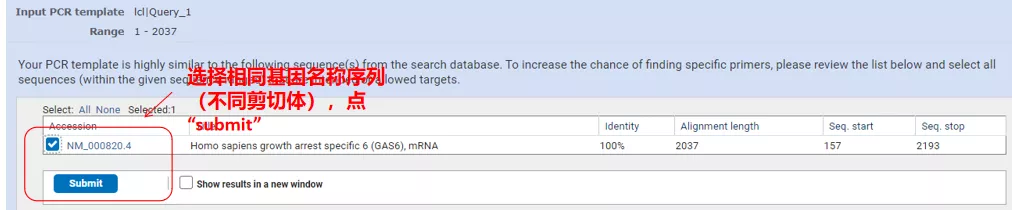
Fai clic su "Ottieni primer" e NCBI apparirà per dirti che tale selezione di parametri verrà amplificata ad altre varianti di splicing.Possiamo controllare le diverse varianti di splicing e inviarle per ottenere la coppia di primer appropriata (come mostrato nella figura sottostante).L'esecuzione di questo processo potrebbe richiedere decine di secondi.
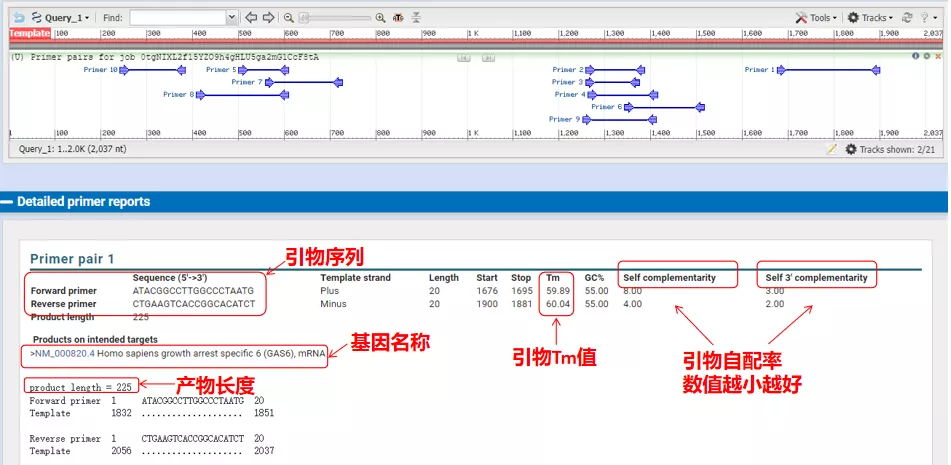 Le temperature di ricottura di queste coppie di primer sono tutte intorno ai 60°C.In base allo scopo dell'esperimento, scegli primer di lunghezza moderata, buona specificità e minore autocomplementazione dei primer per l'esperimento e il tasso di successo è piuttosto alto!
Le temperature di ricottura di queste coppie di primer sono tutte intorno ai 60°C.In base allo scopo dell'esperimento, scegli primer di lunghezza moderata, buona specificità e minore autocomplementazione dei primer per l'esperimento e il tasso di successo è piuttosto alto!
04Verifica della specificità del primer
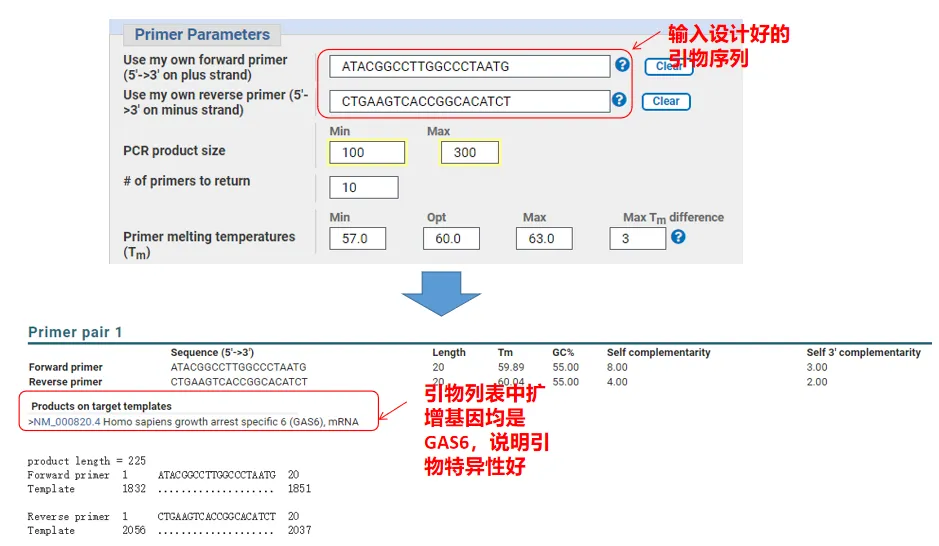
Infatti, oltre a progettare i primer, Primer-Blast può anche valutare i primer che abbiamo progettato noi stessi.Torna alla pagina di progettazione del primer, inserisci i primer a monte ea valle che abbiamo progettato e altri parametri non verranno regolati.Dopo l'invio, puoi vedere se la coppia di primer esiste anche su altri geni.Se tutti sono visualizzati sul gene che vogliamo amplificare, ciò indica che la specificità di questa coppia di primer è ottima!(Ad esempio, questo è l'unico risultato della query primer!)
05 Giudizio sulla qualità del primer
Che tipo di primer è il primer "perfetto" che combina "efficienza di amplificazione fino allo standard", "caratteristiche del prodotto amplificate" e "risultati sperimentali affidabili"?
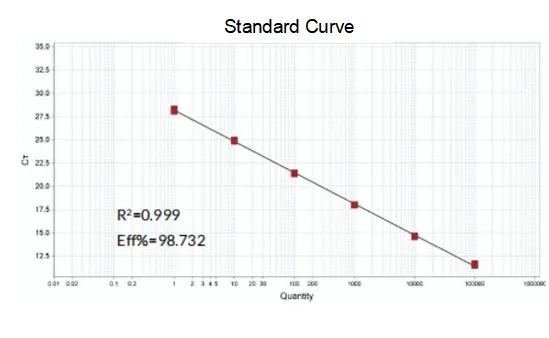 Efficienza di amplificazione
Efficienza di amplificazione
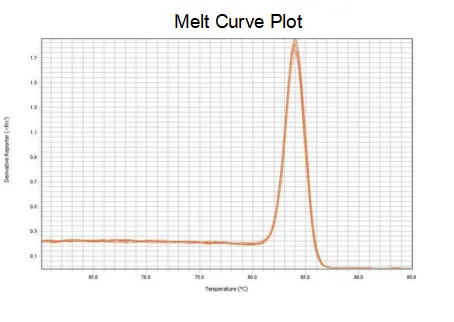 curva di fusione
curva di fusione
L'efficienza di amplificazione dei primer raggiunge il 90%-110%, il che significa che l'efficienza di amplificazione è buona e la curva di melting ha un singolo picco e solitamente Tm>80°C, il che significa che la specificità di amplificazione è buona.
Prodotti correlati:
Real Time PCR Easy–SYBR GREEN I
PCR in tempo reale Easy-Taqman
Tempo di pubblicazione: Feb-10-2023








